Materi Kimia - Laju Reaksi Kelas 11 MIA - Belajar Pintar
BelajarPintarV3
Peta Belajar Bersama
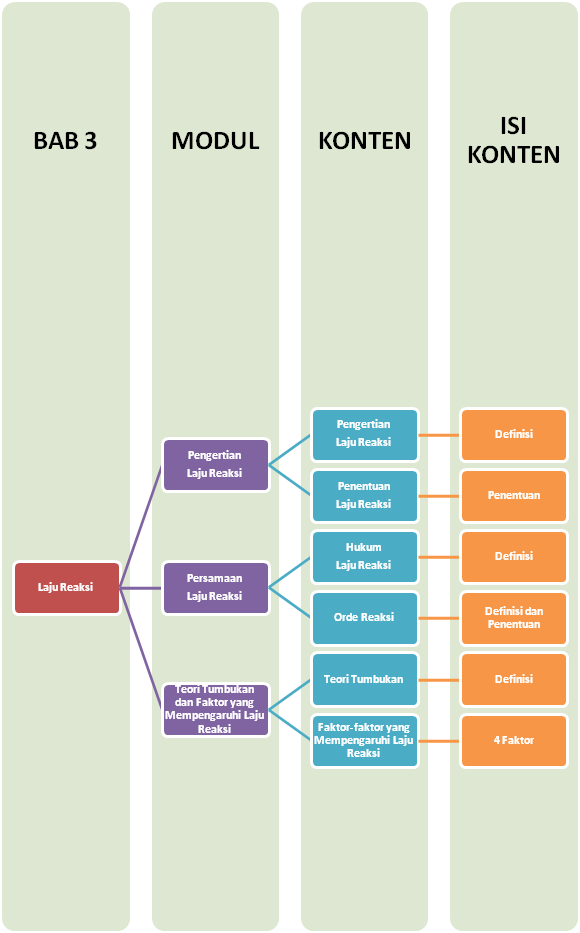
Sobat, ini nih, ada Peta Belajar Bersama Kimia di bab ketiga.
Yuk, mulai belajar bersama!
Pengertian Laju Reaksi

Laju Reaksi adalah laju berkurangnya jumlah pereaksi untuk satuan waktu atau bertambahnya jumlah hasil reaksi untuk setiap satuan waktu.
Ukuran jumlah zat dalam reaksi kimia umumnya dinyatakan sebagai konsentrasi molar atau molaritas (M), dengan demikian maka laju reaksi menyatakan berkurangnya konsentrasi pereaksi atau bertambahnya konsentrasi zat hasil reaksi setiap satu satuan waktu (detik). Satuan laju reaksi dinyatakan dalam satuan mol dm-3 det-1 atau mol/liter detik.
Stoikiometri laju reaksi
Secara umum untuk reaksi yang dinyatakan dengan persamaan reaksi :
aA + bB ---> cC + dD
Berlaku :
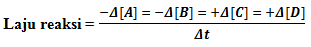
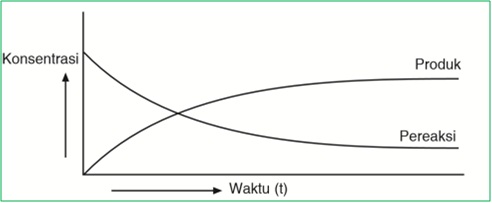
Jika dalam grafik, laju reaksi digambarkan sebagai berikut:
Hukum Laju Reaksi

Hukum laju reaksi adalah persamaan yang menghubungkan laju reaksi dengan konstanta laju dan konsentrasi reaktan. Salah satu cara untuk mengkaji pengaruh konsentrasi reaktan terhadap laju reaksi ialah dengan menentukan bagaimana laju awal bergantung pada konsentrasi awal.
Pengukuran laju secara percobaan nantinya akan menghasilkan hukum laju untuk reaksi yang menyatakan laju dalam konstanta laju dan konsentrasi reaktan. Ketergantungan laju pada konsentrasi menghasilkan orde reaksi.
Konstanta laju reaksi atau tetapan laju reaksi adalah tetapan yang harganya bergantung pada jenis pereaksi, suhu dan katalis.
Suatu reaksi dapat dinyatakan berorde nol jika laju tidak bergantung pada konsentrasi reaktan dan berorde pertama jika lajunya bergantung pada konsentrasi reaktan dipangkatkan satu. Selain orde nol dan satu, juga terdapat orde yang lebih tinggi dan orde pecahan.
Satu ciri penting dari laju reaksi ialah waktu yang diperlukan untuk menurunkan konsentrasi suatu reaktan menjadi setengah dari konsentrasi awalnya, atau biasa disebut waktu paruh. Untuk reaksi orde pertama, waktu paruh tidak bergantung pada konsentrasi awal.
Secara umum untuk reaksi :
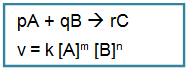
Keterangan :
v = Laju reaksi (M.det-1)
k = Tetapan Laju Reaksi
m = Tingkat reaksi (orde reaksi) terhadap A
n = Tingkat reaksi (orde reaksi) terhadap B
[A]= Konsentrasi awal A
[B]= Konsentrasi awal B
Teori Tumbukan

Reaksi kimia dapat berlangsung apabila terjadi tumbukan antarmolekul.
Teori tumbukan adalah teori yang menjelaskan pengaruh faktor terhadap laju reaksi.
Menurut teori tumbukan, suatu reaksi berlangsung sebagai hasil tumbukan antar partikel pereaksi yang memiliki energi cukup dan arah tumbukan yang tepat.
Berdasarkan teori tumbukan, laju reaksi akan bergantung pada tiga hal utama berikut:
- Frekuensi tumbukan
- Energi partikel reaktan
- Arah tumbukan
Energi aktivasi/pengaktifan (Ea) adalah energi minimum yang harus dimiliki reaktan, yang digunakan untuk mengaktifkan kemampuan reaksi sehingga reaktan dapat bereaksi.
Teori tumbukan dan energi aktivasi berguna untuk menjelaskan faktor-faktor yang mempengaruhi laju reaksi. Laju suatu reaksi kimia dapat dipercepat dengan cara memperbesar harga energi kinetik molekul atau menurunkan harga energi aktivasi.
Jika digambarkan dalam grafik adalah sebagai berikut:
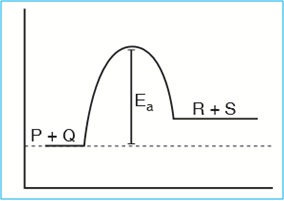
Makna energi aktivasi:
- Jika bernilai rendah, berarti reaksi dapat terjadi pada suhu rendah.
- Jika bernilai tinggi, berarti reaksi dapat terjadi pada suhu tinggi
Materi Kimia SMA - 11 MIA Lainnya
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved