Materi Kimia - Hidrolisis Garam Kelas 11 MIA - Belajar Pintar
BelajarPintarV3
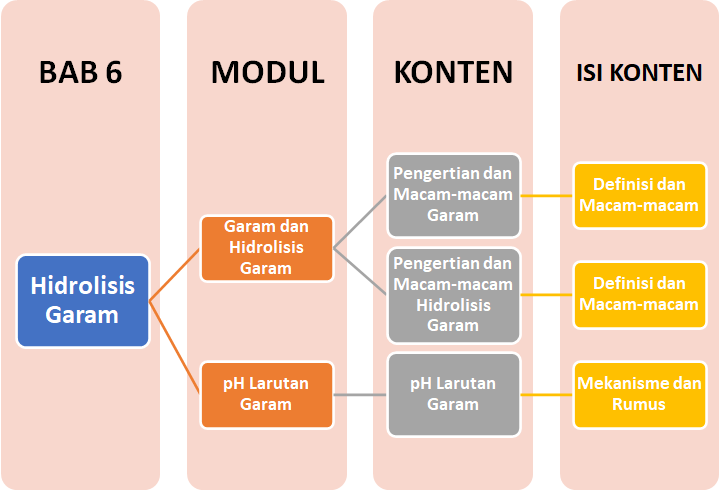
Peta Belajar Bersama
Sobat, ini nih, ada Peta Belajar Bersama Kimia di bab keenam.
Yuk, mulai belajar bersama!
Pengertian dan Macam-macam Garam

Perhatikan gambar di bawah ini!

Apa sih yang kalian ketahui tentang garam ? Selain memiliki rasa yang asin dan sering dikaitkan dengan salah satu bumbu masakan, yaitu garam dapur atau NaCl, dalam reaksi penetralan Garam sendiri merupakan zat yang dihasilkan dari reaksi netralisasi asam dan basa.
Macam-macam garam:
- Garam dari asam kuat dan basa kuat, bersifat netral (pH = 7).
Contoh: NaCl, KCl, K2SO4, Ca(NO3)2. - Garam dari asam kuat dan basa lemah, bersifat asam (pH < 7).
Contoh: Zn(ClO4)2, NH4Cl, AlCl3, Fe(NO3)3. - Garam dari basa kuat dan asam lemah, bersifat basa (pH > 7).
Contoh: Na2SO3, KCN, Na2CO3, (CH3COO)2Ca. - Garam dari asam lemah dan basa lemah, sifat bergantung pada Ka dan Kb.
Contoh: Zn(NO2)2, CH3COONH4, Fe3(PO4)2.
pH Larutan Garam

pH larutan garam dari asam dan basa kuat yang tepat habis bereaksi adalah pH = 7.
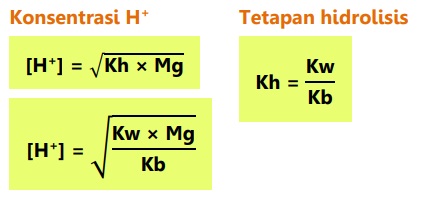
pH larutan garam dari asam dan basa bukan kuat dihitung dengan tetapan hidrolisis (Kh), dan tetapan ionisasi asam dan basa (Ka dan Kb).
Garam dari asam kuat dan basa lemah bersifat asam atau pH < 7.
Jika garam berasal dari kation atau anion yang salah satunya bervalensi dua, maka:
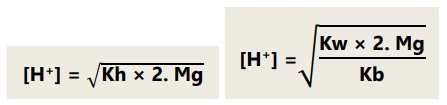
Garam dari basa kuat dan asam lemah bersifat basa atau pH > 7.
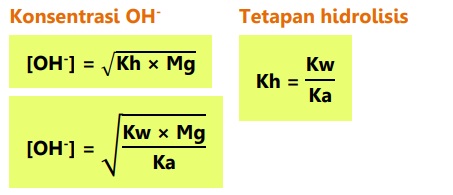
Jika garam berasal dari kation atau anion yang salah satunya bervalensi dua, maka:
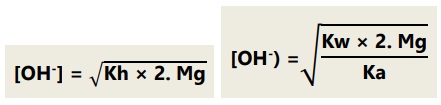
Garam dari asam lemah dan basa lemah:
- Jika Ka = Kb
Maka garam bersifat netral atau pH = 7. - Jika Ka > Kb
Maka garam bersifat asam atau pH < 7.
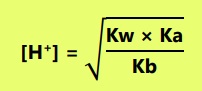
- Jika Kb > Ka
Maka garam bersifat basa atau pH > 7.

Derajat hidrolisis adalah derajat yang menunjukkan tingkat kesempurnaan hidrolisis.
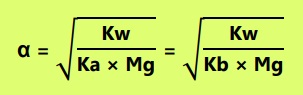
Keterangan :
[H+] : konsentrasi ion H+
[OH-] : konsentrasi ion OH-
Kw : tetapan kesetimbangan air
Ka : tetapan ionisasi asam lemah
Kb : tetapan ionisasi basa lemah
Kh : tetapan hidrolisis
Mg : komponen garam yang mengalami hidrolisis
alfa : derajat ionisasi
Materi Kimia SMA - 11 MIA Lainnya
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved