Materi Kimia - Hidrokarbon dan Minyak Bumi Kelas 11 MIA - Belajar Pintar
BelajarPintarV3
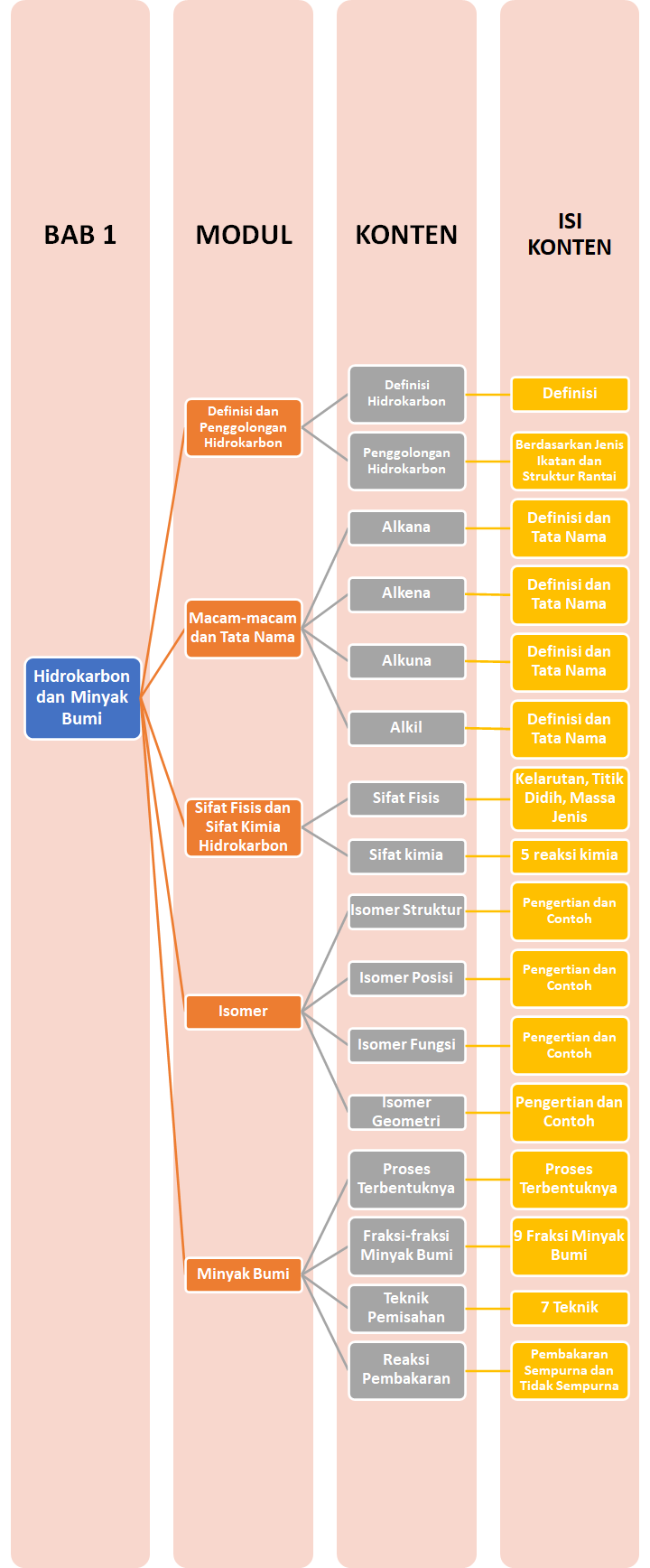
Peta Belajar Bersama
Sobat, ini nih, ada Peta Belajar Bersama Kimia di bab pertama.
Yuk, mulai belajar bersama!
Definisi Hidrokarbon

Hidrokarbon adalah sebuah senyawa yang terdiri dari unsur karbon (C) dan hidrogen (H). Seluruh hidrokarbon memiliki rantai karbon dan atom-atom hidrogen yang berikatan rantai-rantai tersebut. Misal jika rantai karbonnya terbuka disebut senyawa karbon alifatik seperti hidrokarbon golongan alkana, alkena dan alkuna sedangkan rantai karbonnya tertutup disebut senyawa karbon alisiklik seperti senyawa siklopentana dan aromatik seperti senyawa benzena.
Karbon mempunyai nomor atom 6 dengan 4 elektron valensi, sehingga mampu membentuk ikatan kovalen dan dapat membentuk rantai karbon yang panjang sehingga jumlahnya banyak.
Atom karbon (C) dengan nomor atom 6 mempunyai susunan elektron K=2 dan L=4. Atom karbon mempunyai 4 elektron valensi dan dapat membentuk empat ikatan kovalen. Sebagai contoh, molekul CH4 (metana) yang memiliki diagram yang cukup sederhana dibawah ini.
Contoh Hidrogen (Metana)
Dalam kimia karbon, penting bagi kita untuk dapat menuliskan rumus molekul dan rumus struktur. Rumus molekul menyatakan jumlah atom setiap unsur yang ada dalam suatu molekul. Sedangkan rumus struktur menggambarkan bagaimana atom-atom itu terikat satu sama lain.
Alkana

Senyawa hidrokarbon yang semuanya berikatan tunggal disebut Alkana. Secara umum senyawa alkana dapat dirumuskan:
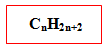
Senyawa alkana diakhiri dengan kata -ana. Pada rantai alkana, kenaikan panjang rantai dalam senyawa alkana selalu berselisih CH2. Kenaikan panjang rantai dengan selisih sama disebut deret homolog. Deret homolog alkana beserta namanya dapat dilihat dalam tabel berikut:
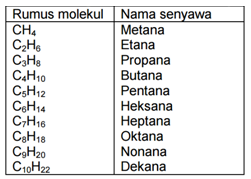
Senyawa alkana seperti dalam tabel di atas dapat berupa rantai bercabang dan rantai tidak bercabang
Contoh alkana rantai tidak bercabang (lurus) :
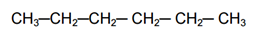
Contoh alkana rantai bercabang :
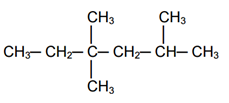
Sobat untuk Tata nama senyawa Alkana Tata nama senyawa alkana dibagi menjadi dua yaitu senyawa alkana rantai lurus dan rantai bercabang.
1. Tata nama Alkana rantai lurus :
Nama senyawa dituliskan dengan urutan sebagai berikut : “ normal (n)-Alkana” Keterangan :
Alkana = adalah nama pada deret homolog alkana sesuai dengan jumlah atom C nya
Contoh:
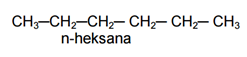
2. Tata nama Alkana rantai bercabang
Langkah penamaan senyawa alkana rantai bercabang adalah sebagai berikut ;
- Tentukan rantai utama yaitu rantai karbon terpanjang yang memiliki jumlah C paling banyak . Jika terdapat beberapa pilihan rantai utama, pilihlah rantai yang memiliki jumlah cabang yang lebih banyak. Selain rantai utama disebut rantai cabang
- Penomoran atom C rantai utama Prioritas penomoran atom C rantai utama adalah sebagai berikut :
1) Penomoran atom C dimulai dari salah satu ujung rantai yang paling dekat dengan letak cabang sehingga cabang terletak di nomor yang terkecil
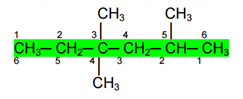
Rantai utama misalnya adalah rantai C yang diarsir dengan jumlah C = 6 Penomoran atom C pada rantai tersebut harus dimulai dari kanan, karena nomor cabang jika dimulai dari kiri adalah nomor 3, 3 dan 5 sedangkan jika dimulai dari kanan nomor cabang adalah 2, 4 dan 4
2) Jika jumlah nomor cabangnya sama, pilihlah penomoran yang mengandung nomor cabang yang terkecil
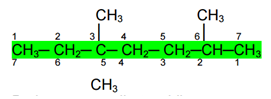
Pada senyawa di atas, bila penomoran dimulai dari kanan cabang berada di nomor 2, 5 dan 5, jumlah nomor cabang adalah (2 + 5 + 5) = 12. Jika penomoran dimulai dari kiri, cabang berada di nomor 3, 3 dan 6, jumlah nomor cabang (3 + 3 + 6) = 12. Berarti jumlah nomor cabang baik dimulai dari kiri maupun dari kanan sama, oleh karena itu penomoran dipilih yang mengandung nomor terkecil, yaitu 2. Jadi penomoran atom C rantai utama pada senyawa di atas adalah dari kanan.
3) Jika jumlah nomor cabang sama, nomor terkecilnya juga sama, pilihlah cabang besar terletak di nomor kecil
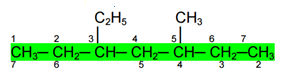
Pada senyawa diatas, letak cabang jika dimulai dari kiri dan kanan sama yaitu berada di nomor 3 dan 5, sehingga jumlah nomor cabangnya sama dan nomor terkecilnya juga sama. Dengan demikian penomoran menggunakan prioritas ketiga yaitu cabang besar berada di nomor kecil. Jadi penomoran dimulai dari kiri karena cabang C2H5 lebih besar daripada cabang CH3.
Penulisan nama senyawa ditulis sesuai dengan urutan berikut:
- “Nomor cabang nama cabang nama rantai utama”
- Nama cabang menggunakan nama alkil yang sesuai jumlah atom C-nya
- Jika terdapat dua atau lebih cabang yang sama penyebutan nama cabang digabung dengan memberi awalan di untuk 2, tri untuk 3, tetra untuk 4, penta untuk 5 dan seterusnya tetapi nomor cabang tetap harus dituliskan.jika terdapat cabang yang berbeda, penulisannya diurutkan abjad huruf depan nama cabangnya
- Nama rantai utama menggunakan nama deret alkana yang sesuai jumlah atom C-nya
- Nomor cabang harus ditulis secara keseluruhan meskipun terletak pada atom c yang sama (nomor cabang sama)
- Nomor cabang harus ditulis secara keseluruhan meskipun terletak pada atom c yang sama (nomor cabang sama)
Contoh:
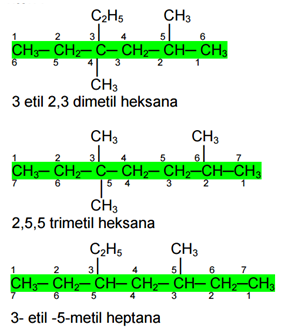
Sifat Fisis

Sifat fisis senyawa hidrokarbon
Kelarutan
Senyawa hidrokarbon (alkana, alkena dan alkuna) adalah senyawa yang bersifat non polar, sehingga kelarutannya akan baik jika berada pada pelarut senyawa yang juga non polar (alkohol dan eter). Kelarutannya dalam air akan dipengaruhi oleh besarnya massa molekul relatif (Mr). Semakin besar Mr senyawanya, makin kecil kelarutannya dalam air.
Titik didih
Titik didih senyawa hidrokarbon (alkana, alkena dan alkuna) adalah besarnya energi yang diperlukan untuk melepaskan molekul senyawa tersebut dari lingkungannya yang berwujud cair sehingga menjadi berwujud gas. Besarnya titik didih senyawa hidrokarbon akan semakin tinggi jika Mr senyawa semakin besar. Berikut adalah tabel titik didih senyawa hidrokarbon:
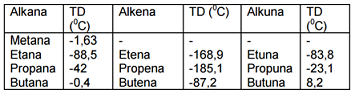
Senyawa hidrokarbon yang memiliki isomer titik didihnya akan semakin tinggi jika rantai utamanya semakin panjang.
Massa Jenis
Massa jenis dari senyawa hidrokarbon berbanding lurus dengan panjangnya rantai karbon yang dimiliki. Semakin panjang rantai karbonnya atau semakin banyak atom karbon yang dimiliki, maka massa jenis senyawa hidrokarbon tersebut semakin besar.
Untuk sifat kimianya, yuk Sobat Pintar lanjut ke halaman berikutnya
Isomer Struktur

Hidrokarbon Isomer adalah senyawa dengan rumus molekul sama tetapi memiliki perbedaan seperti misalnya bentuk rangkanya, letak ikatan rangkapnya, dan jenis ikatan rangkapnya maupun berbeda jika ditinjau dari segi keruangannya.
Isomer struktur
Yaitu senyawa yang memiliki rumus molekul sama tetapi memiliki rumus struktur yang berbeda. Isomer ini berlaku untuk alkana, alkena maupun alkuna
Contoh :
Isomer dari C4H10
struktur-struktur yang mungkin adalah :
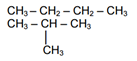
Jadi C4H10 memiliki isomer 2 buah.
Proses Terbentuknya Minyak Bumi

Minyak bumi terbentuk dari penguraian senyawa-senyawa organik dari jasad mikroorganisme jutaan tahun yang lalu di dasar laut. Hasil peruraian yang berbentuk cair akan menjadi minyak bumi dan yang berwujud gas menjadi gas alam.
Proses penguraian tersebut berlangsung sangat lamban sehingga untuk membentuk minyak bumi dibutuhkan waktu yang sangat lama. Itulah sebabnya minyak bumi termasuk sumber daya alam yang tidak dapat diperbarui, sehingga dibutuhkan kebijaksanaan dalam eksplorasi dan pemakaiannya. Untuk mendapatkan minyak bumi ini dapat dilakukan dengan pengeboran.
Lokasi Pengeboran Minyak yang Berada di Lepas Pantai
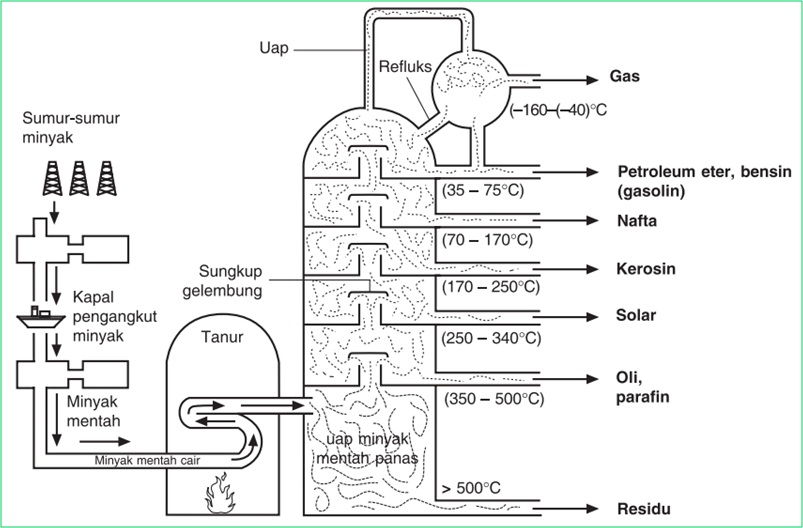
Minyak bumi merupakan campuran senyawa-senyawa hidrokarbon. Untuk dapat dimanfaatkan perlu dipisahkan melalui distilasi bertingkat, yaitu cara pemisahan fraksi-fraksi minyak bumi berdasarkan perbedaan titik didihnya pada kolom bertingkat.
Untuk menentukan secara akurat keberadaan minyak mentah di dalam bumi menggunakan teknik gelombang seismik. Gelombang seismik adalah rambatan energi yang disebabkan karena adanya gangguan di dalam kerak bumi, misalnya adanya patahan atau adanya ledakan. Energi ini akan merambat ke seluruh bagian bumi dan dapat terekam oleh seismometer.
Komponen utama minyak bumi dan gas alam adalah alkana. Gas alam mengandung 80% metana, 7% etana, 6% propana, 4% butana dan isobutana, sisanya pentana. Untuk dapat dimanfaatkan, gas propana dan butana dicairkan yang dikenal sebagai LNG (Liquid Natural Gas). Karena pembakaran gas alam murni lebih efisien dan sedikit polutan, maka gas alam banyak digunakan untuk bahan bakar industri dan rumah tangga. Dalam tabung kecil sering digunakan untuk berkemah, piknik, dan sebagai pemantik api. LNG juga banyak digunakan untuk bahan dasar industri kimia seperti pembuatan metanol dan pupuk.
Senyawa penyusun minyak bumi: alkana, sikloalkana, dan senyawa aromatik. Di samping itu terdapat pengotor berupa senyawa organik yang mengandung S, N, O, dan organo logam. Dari hasil distilasi bertingkat diperoleh fraksi-fraksi LNG, LPG, petroleum eter, bensin, kerosin, solar, oli, lilin, dan aspal.
Skema proses distilasi bertingkat atau distilasi fraksinasi digambarkan pada gambar berikut ini:
Materi Kimia SMA - 11 MIA Lainnya
footer_v3
Bersama Aku Pintar temukan jurusan kuliah yang tepat
sesuai minat dan bakatmu.
Aku Pintar memiliki visi membuat pendidikan merata, mudah dijangkau, dan terjangkau dengan Program Journey Pintar yang merupakan sebuah program persiapan lengkap bagi siswa SMA/SMK/sederajat yang ingin masuk ke perguruan tinggi impiannya.
Kontak Kami
Grand Slipi Tower Lt. 42
Jl. S. Parman Kav 22-24
Jakarta Barat
© 2024 Aku Pintar. All Rights Reserved